
1. Desnudando un huevo
- Huevo crudo
- Vaso de tubo o similar
- Vinagre
El experimento
1. Introduce el huevo en el vaso y añade vinagre hasta que lo cubra
4. Al cabo de siete días, retira el vinagre y lava cuidadosamente el huevo con agua
5. Ya tienes un huevo «desnudo»
 |
| Una vez finalizado el experimento puedes probar a observar el huevo sobre una fuente de luz. (Fuente) |
¿Qué ha ocurrido?
– además, el calcio y el acetato forman acetato cálcico
2 CH3COOH + CaCO3 = H2CO3 + Ca(CH3COO)2
– posteriormente el ácido carbónico se «rompe» para formar dióxido de carbono y agua
2 CH3COOH + CaCO3 = H2O + CO2 + Ca(CH3COO)2
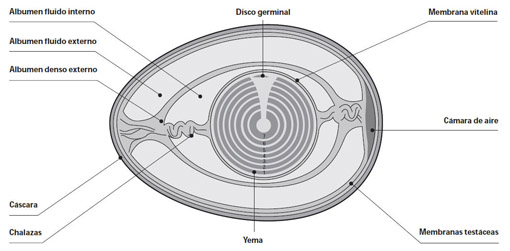 |
| Lo que sucede al introducir un huevo en vinagre es que la cutícula y el carbonato cálcico son retirados de la cáscara y el interior del huevo queda cubierto solamente por las membranas testáceas. (Fuente) |
2. Hierro de desayuno
- Cereales con hierro añadido
- Un imán potente
- Una bolsa con cierre hermético (tipo zip o similar)
- Agua
3. Cristales de azúcar
Material necesario
- Azúcar
- Agua
- Cazuela
- Tarro de cristal o similar
- Lápiz o similar
- Cordel o palo de madera (de helado, de pincho moruno, etc.)
- Colorante alimentario (opcional)
- Aroma alimentario (opcional)
El experimento
¿Qué ha sucedido?
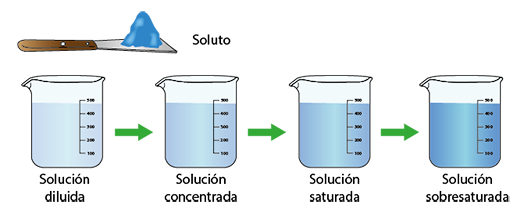 |
| Para que se produzca la cristalización debe partirse de una solución sobresaturada. (Fuente) |
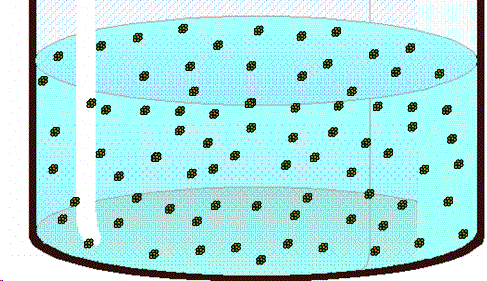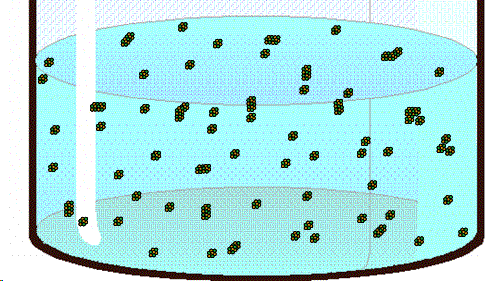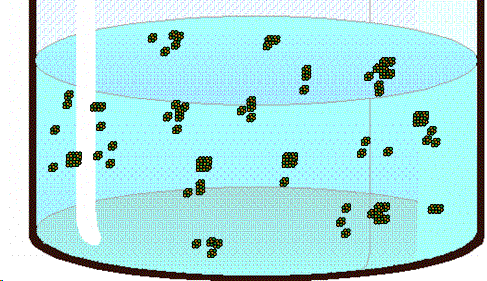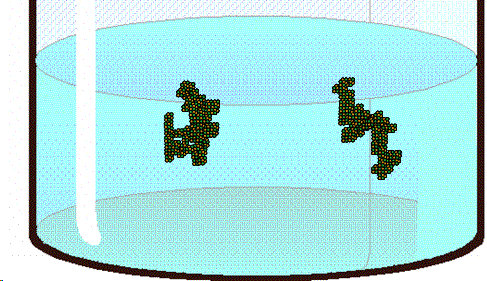 |
| Los pequeños cristales de azúcar formados en el cordel sirven de puntos de nucleación para las moléculas de sacarosa, uqe llegan a formar así grandes estructuras cristalinas. (Fuente) |
4. Helado casero
Material necesario
- Azúcar (en el vídeo recomiendan azúcar moreno)
- Dos bolsas de cierre hermético (tipo zip)
- Utensilios de medida
- Hielo
- Sal gruesa
- Aroma de vainilla (opcional)
- Nata líquida
- Tarro grande de cristal con tapa (o similar)
- Guantes
El experimento
¿Qué ha sucedido?
5. Refresco invisible
Material necesario
- Refresco de cola
- Leche
El experimento
1. Abre una botella de refresco de cola y añade un 2% de leche.
2. Observa lo que sucede
Los cambios se producen de forma lenta, pero se aprecian fácilmente. Puedes echar una ojeada cada media hora, o cada hora.
¿Qué ha sucedido?
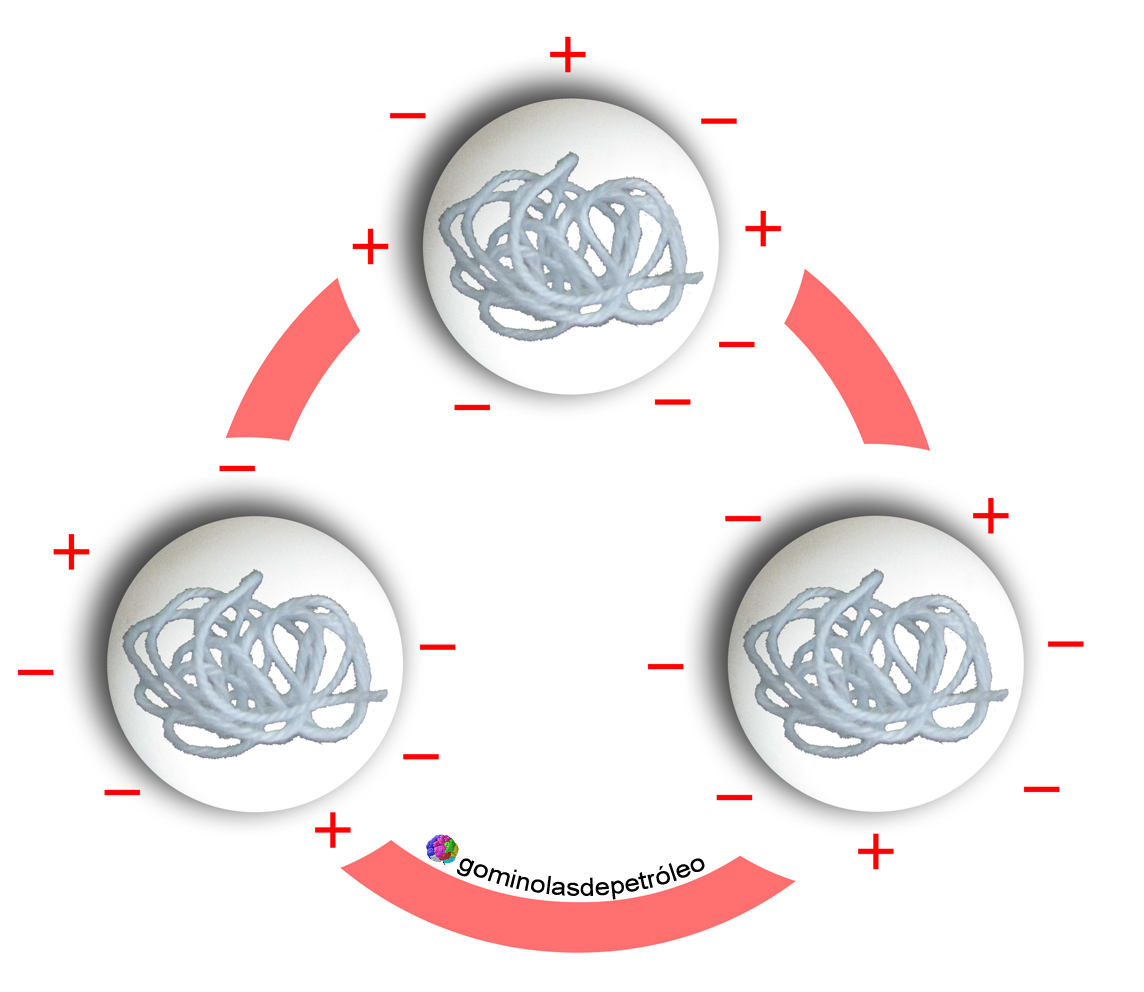 |
| Las caseínas son las proteínas más importantes de la leche, en la que a un pH normal (6,6) tienen una carga neta negativa. |
Un refresco de cola contiene diferentes ácidos (principalmente ácido carbónico y, sobre todo, ácido fosfórico), por lo que su pH es bastante bajo (en torno a 3). Cuando añadimos leche al refresco, la carga de las proteínas cambia, de modo que a medida que el pH va disminuyendo, el número de cargas positivas va aumentando. Llega un momento (pH=4,7) en el que la carga neta es nula, es decir las cargas negativas y las positivas se igualan (a esto se le llama punto isoléctrico), de manera que las proteínas se unen entre sí y el equilibrio que había hasta ahora se rompe. Mediante estas uniones se forman agregados de gran tamaño y de elevado peso que no pueden mantenerse en suspensión, así que precipitan arrastrando a su paso otras sustancias, como las que aportan color al refresco.
 |
| Los autores del vídeo probaron además con diferentes sustancias, como leche desnatada, leche entera, leche de soja, nata y leche de almendras. (Fuente) |
6. La química de la lombarda
Si te fascina el color de la lombarda, no te pierdas el siguiente vídeo:
Material necesario
- Lombarda. Si no puedes conseguirla fácilmente, puedes probar con cerezas, uvas tintas, moras o arándanos.
- Agua
- Batidora
- Colador
- Tres vasos
- Papel blanco
- Delantal (las manchas son difíciles de quitar)
- Sustancias de ensayo: bicarbonato sódico, zumo de limón, vinagre, y todo lo que se te ocurra
El experimento
¿Qué ha sucedido?
7. El ADN de las fresas
Material necesario
- Fresas
- Alcohol isopropílico (5ml) (si no lo puedes conseguir fácilmente, mira a ver si tienes a mano un limpiador de discos de vinilo y fíjate en su composición, algunos están compuestos por este alcohol).
- Jabón lavavajillas (10 ml)
- Sal
- Bolsa de cierre hermético (tipo zip)
- Agua (90ml)
- Utensilios de medida
- Colador
- Vasos
- Pinzas
- Cuchara
El experimento
¿Qué ha sucedido?

Fuentes
http://www.stevespanglerscience.com/lab/experiments/naked-egg-experiment
http://www.scienceofcooking.com/naked_egg_experiment.htm
http://www.stevespanglerscience.com/lab/experiments/eating-nails-for-breakfast
http://www.stevespanglerscience.com/lab/experiments/homemade-rock-candy
http://www.stevespanglerscience.com/lab/experiments/brown-sugar-homemade-ice-cream
http://www.stevespanglerscience.com/lab/experiments/red-cabbage-chemistry
http://www.stevespanglerscience.com/lab/experiments/berry-ph-paper-sick-science
http://www.stevespanglerscience.com/lab/experiments/invisible-soda
http://eltamiz.com/2007/08/22/falacias-la-coca-cola-es-mala-por-ser-muy-acida/
http://www.stevespanglerscience.com/lab/experiments/strawberry-dna





Muy interesante y con posibilidades divertidas el articulo.Enhorabuena por tu blog y feliz año a ti tambien.